在1466个完成的首次IND审查中,有1404个(96%)获得批准。被拒原因主要包括申请后研究信息缺乏导致沟通不畅、药物临床效益风险比不合理以及违反临床诊断基本原则等。首次IND批准的创新药物数量每年增长35%,其中2016年首次IND批准的创新药物数量显著增加。
2015年7月,中国出台了监管改革措施,缓解了申请积压,鼓励了药物创新。与此同时,创新药物的首次IND申请和批准数量大幅增加。
获批的创新药物NDA数量虽少,但在不断增长。2010至2020年期间,共提交101种创新药物NDA,58种创新药物获批。近年来,提交和批准的NDA数量普遍增加(图1b),58个获批创新药中有42个(72%)自2015年7月之后获批。
在已完成的66个药物首次NDA审查中,有58个(88%)获得批准。未获批主要原因是药物或临床研究设计存在重大缺陷、不同开发阶段使用的研究样本不一致以及审查中发现的临床试验数据不真实。
在58个获得批准的创新药物中,37种药物为通过中国国家药品监督管理局(NMPA)批准的新分子实体(NME),而另21种药物为在国外批准或销售的药物、传统疫苗、血液制品、细胞因子等(补充表1)。而且,有14种药物(24%)为孤儿药,其中13种药品符合美国食品药品管理局的孤儿药标准。此外,40种创新药物(69%)获得了优先审评,其中35种(88%)在2015年7月之后获批(补充表1)。数据表明,2015年8月推出的优先审评等监管改革措施鼓励了机构创新。
肿瘤学是创新药物的主要领域,大多数药物处于早期开发阶段。首次申请IND获批的创新药物的主要治疗类别是肿瘤学(864,62%)、感染(166,12%)、内分泌疾病(72,5%)和心血管疾病(60,4%)。2016年获批首次IND申请的肿瘤药物数量显著增加,增长率为133%(补充框1)。
在首次申请IND获批的创新药物中,705种药物(50%)至少进行到Ⅰ期实验,286种(20%)和108种(8%)药物分别达到了Ⅱ期和Ⅲ期阶段。大多数抗癌药物(57%)进展尚未超过Ⅰ期(图2a)。
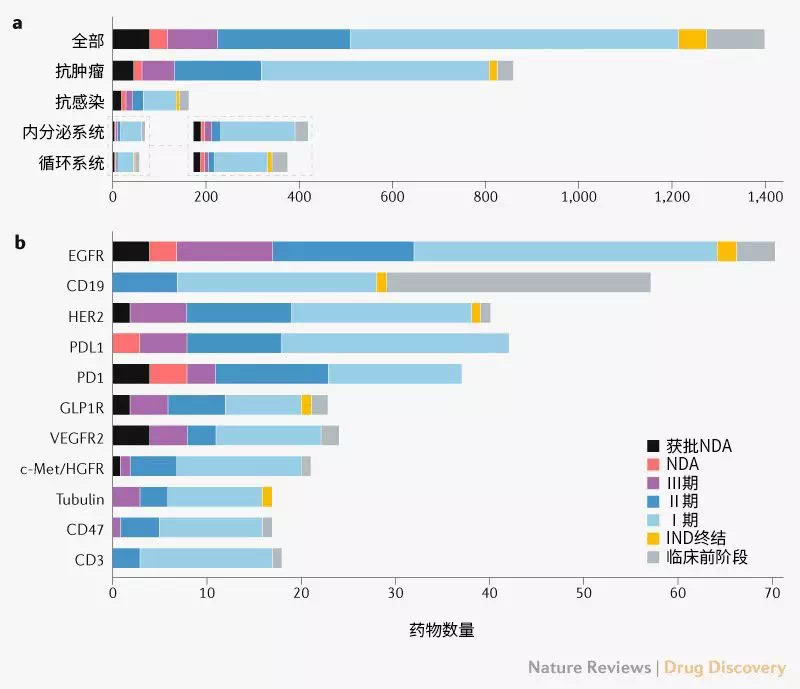
图2 | 创新药物开发阶段。a | 主要治疗类别。b | 药物靶点。药物可以针对单一靶点,也可以针对多个靶点。详见补充信息。