一年以来,围绕阿杜卡玛单抗的争议从未停止 | 图源:medpagetoday
一年前(2021年6月),美国食品和药物管理局 (FDA)通过快速审批通道批准了由渤健(Biogen)和卫材(Eisai)共同研发的阿尔茨海默症新药阿杜卡玛单抗(aducanumab,商品名Aduhelm,中文名阿杜卡玛单抗)。产业界曾认为,这让在过去十年间已成明日黄花的神经科学领域重新迎来 “黄金时代”。然而一年以来,围绕阿杜卡玛单抗的争议从未停止。2022年6月16日,被寄予厚望的相似药物crenezumab的临床Ⅱ期实验未能达到主要终点。AD领域的药物研发仍未打破失败魔咒。回望一年以来针对阿杜卡玛单抗的种种讨论,我们希望厘清关于AD研发的争议根源。
● ● ●
阿杜卡玛单抗是一款选择性靶向Aβ淀粉样蛋白斑块的单克隆抗体药物,治疗原理是通过激活免疫系统将沉积的蛋白斑块清除出患者大脑。现有其他药物仅可短期改善症状,阿杜卡玛单抗则是针对阿尔茨海默症潜在病理生理机制,可有望减缓阿尔茨海默症的进程。2015年,渤健启动了针对阿杜卡玛单抗的两项3期临床试验:ENGAGE和EMERGE。2019年3月,在经过对数据的中期分析(interim analysis)后,渤健认为阿杜卡玛单抗对阿尔茨海默症患者的轻度认知功能损伤没有改善作用,很可能难以到达主要疗效终点,因而宣布提前终止临床试验。但后来渤健通过对数据重新分类整理,以及中期分析锁库到临床试验终止期间产生的新数据加入,发现在EMERGE中最高剂量的阿杜卡玛单抗(10mg/kg)能够显著改善患者认知能力。这一发现让渤健决定重新启动对阿杜卡玛单抗的新药上市申请程序。2020年11月,FDA召开专家顾问咨询委员会会议,会中11位专家中8人反对,2人弃权,共10位专家都对阿杜卡玛单抗给予了负面评价。次年(2021年),FDA又举行了多次内部会议,最终力排众议,通过了阿杜卡玛单抗的上市申请。彼时,FDA显然早已预料到阿杜卡玛单抗的获批会遭到很多反对,因此在宣布批准药物上市的同时,又发布一份署名为药品审评与研究中心(CDER)主任 Patrizia Cavazzoni 的说明 [1]。Cavazzoni指出,尽管阿杜卡玛单抗的数据在其临床获益方面很复杂,但FDA已经确定有大量证据表明阿杜卡玛单抗减少了患者大脑中的β淀粉样斑块,并且这些斑块的减少能够合理预测患者服用药物后的重要获益。由于FDA批准了阿杜卡玛单抗,阿尔茨海默症患者有了一种重要且关键的新药来帮助他们对抗这一疾病。她表示,在阿杜卡玛单抗进入市场并最终用到患者身上时 , FDA表示将继续对其进行监控。此外,FDA要求渤健开展批准后临床试验,以确证该药的临床获益。如果药物不能按预期发挥作用,将采取措施将其从市场上撤销。然而,FDA或许也没有预料到,顶住压力批准其上市仅仅是拉开了阿杜卡玛单抗争议的序幕。
FDA针对阿杜卡玛的上市决议在医药界引发了巨大争议,反对派的理由包括: 1 两项三期临床实验结果相悖:ENGAGE和EMERGE的实验设计相同,但结果相互矛盾,仅EMERGE中的最高剂量组中,MCI和轻度阿尔茨海默症患者的CDR-SB评分均值降低了22%(0.39分)(图1)。图1 ENGAGE和EMERGE中阿杜卡玛单抗对CDR-SB评分的改善 | 来源:Biogen
2 替代终点的可行性存疑:基于良好的临床数据和替代终点,提前批准药物上市是最有价值的审批加速机制。然而以Aβ斑块减少作为阿杜卡玛单抗临床研究的替代终点被认为缺乏理论支撑。Aß斑块是否为AD的致病因素尚无定论,其与改善认知之间更无确定的联系。 3 患者的不良反应明显:41.3%的试验参与者在研究过程中发生了淀粉样蛋白相关的影像学异常(ARIA),表现为脑水肿(ARIA-E)或脑出血(ARIA-H)。ARIA通常不会引起任何症状,部分患者会出现轻微的头痛、精神错乱、头晕、视力改变和恶心等症状。但1%至2%的患者需要住院或有长期损害,包括脑水肿,脑出血和癫痫发作。 4 药价高昂:作为一款需要长期服药和定期观察的药物,患者需要支付药物费用以及辅助服务费用(如监测ARIA的磁共振成像费用等)。每位患者的药物年成本为28,000美元(原价为56,000美元,约合人民币36万元,去年12月渤健将其降至半价)。加州大学洛杉矶分校开展的一项关于阿杜卡玛单抗的成本分析显示,该药物的辅助护理服务占药物相关的医疗保险总成本的近20%,约合每个病人每年6,564美元。
阿杜卡玛单抗上市之后,临床一线的医生仍对药物仍然表现出抗拒倾向。据纽约时报2021年7月报道:美国的多个大型医疗中心(如普罗维登斯医疗集团,西奈山卫生系统和克利夫兰诊所)拒绝为患者开具阿杜卡玛单抗 [3]。2021年7月至9月,美国国会加大了阿杜卡玛单抗的关注,启动了对渤健和FDA的调查,要求双方提供有关该药物评估及监管细节的文件 [4]。2021年12月17日,欧洲药品管理局(EMA)拒绝了阿杜卡玛单抗的上市许可 [5]。历史上EMA与FDA在上市决策保持着高度一致(91-98%),因此该决定引发一片哗然。EMA称,现有实验数据无法证明阿杜卡玛单抗的安全性以及有效性。5天后,日本卫生部也以相似的理由拒绝批准阿杜卡玛单抗的上市申请 [6]。2022年6月9日,渤健主动撤回了阿杜卡玛单抗在加拿大卫生部的监管审查。在此背景下,美国医疗保险和医疗补助服务中心(CMS)的对覆盖范围的决定成了阿杜卡玛单抗能否 “真正上市” 的关键环节。2022年4月,在经历了三个月的公开评论期后,CMS 公布关于阿杜卡玛单抗医疗保险覆盖范围的决定 [7]:将阿杜卡玛单抗和其他可能批准的Aβ单克隆抗体的医保覆盖范围限制在参与CMS或美国国立卫生院(NIH)批准的临床研究的人身上,CMS只会支付该类药物和任何必要医学影像扫描的费用。CMS表示,阿杜卡玛单抗的无效数据意味着该药物不符合全面医疗保险覆盖的 “合理和必要” 标准。上述决定这意味着只有极少数参与研究的人群可以得到政府支持的医疗保障。该决议对于CMS来说并不寻常,据一项2013年的调查,CMS对FDA批准的B类药品/医疗器械(阿杜卡玛单抗就是其中之一)的有着80%的覆盖率,其中的药品更是全覆盖 [8]。CMS最终版本的发布无疑阻塞了该药物走进民众的道路。一年过去,阿尔茨海默症患者群体的境遇并未改变:仍没有可用的疾病改善途径。决策期内,CMS公开评论区中有着大量的重复评论和科学机构的延续质疑声,而零星的患者声量却显得尤其微弱。UsAgainstAlzheimers是一家致力于阻止阿尔茨海默症的创新性非营利组织。该机构直言:“CMS中没有神经科专家、没有临床试验设计专家、没有对治疗药物的安全性和有效性进行评价的经验。它从未承担过这样的职权。” 意指最应该考虑患者需求的CMS在此过程中有越俎代庖之嫌 [9]。图2 阿尔茨海默症活动团体宣传海报 | 来源:UsAgainstAlzheimer
菲尔·古蒂是一名早发型阿尔茨海默症患者,于2016年被确诊。他加入了阿杜卡玛单抗的三期临床实验,连续三年注射低剂量的阿杜海默。菲尔称在实验中感受良好,自己的认知症状得到了显著的改善。因此,临床实验的终止和CMS的决策让他十分失望,“阿尔茨海默症的临床实验曾给了我一线希望,现在一切结束了”。他目前是美国最大的相关运动组织阿尔茨海默症协会(the Alzheimer’s Association)的分会董事,该协会也是积极推动阿杜卡玛单抗推广的重要力量 [10]。然而,这些患者声音背后也有一定质疑声,阿尔茨海默症协会被曝出接受来自渤健的捐赠。伦敦大学学院心理健康研究所老年精神病学教授罗伯特·霍华德指出:“阿尔茨海默症协会和UsAgainstAlzheimers都并非患者群体。他们为一种具有潜在致命副作用的临床无效药物进行游说,暴露出他们对患者根本疏于关照。” 霍华德还谨慎地表示,虽然他无意对任何个人做出评论,但“理论上,这些药物最多只能延缓疾病的发展。”可以说,公开支持阿杜卡玛单抗的声音,无论是政府机关,民间群体,还是患者个人,都不可避免地面对一定程度上的诛心之论。一年过去,阿杜卡玛单抗的市场前景堪忧,渤健如今可谓是四面楚歌。据STAT报道,渤健自三月份便开始大规模裁员,CMS的最终决议后,其宣布将大幅度削减Aduhelm的推广成本,至此,渤健在该药物上的商业努力宣告失败,现任首席执行官 Michel Vounatsos 将辞职。
面对这一药物审查史中的特例,尽管外界反对声浪很高,但实际上拥有多个不同部门、数千名医药领域专家的FDA内部早已在批准上市之前便上演了多轮辩论。但这一细节直到时任美国FDA药品审评研究中心(CDER)临床药理审评部定量药理学审评室主任王亚宁博士离职回国后,才在一些场合披露细节,“希望能够通过对数据的更客观的评价,消除对aducanumab批准的一些误解。” [11]据相关报道 [9],王亚宁博士深度参与了aducanumab的审评工作,他解释了FDA的考量。他认为,综合所有数据,即使只依赖于临床终点,也有足够的证据证明药物的有效性。301和302两项研究的结果的差异主要是受第四版方案修订前(Pre-PV4)中301研究中的高剂量组的数据影响(第四版方案是在研究中期,渤健监测ApoE ε4阳性患者的副作用后进行的一次重要的研究方案修订,将该类患者的高剂量组给药剂量上调至10mg/kg)。王亚宁博士指出,一方面Pre-PV4的数据可能受剂量过低和301研究中严重患者较多的干扰;另一方面,这个偏差值的出现可以解释为统计学中典型的第二类错误,即对一个有效药物进行多次验证比如多剂量、多试验、多人群、多时间点时,允许一定比例的失败出现。如果将所有研究中所有剂量以及所有时间点的数据放在一起综合分析,对于CDR-SB终点,13组数据中唯一不支持药物疗效的就是301研究中高剂量组的Pre-PV4数据(下图红框),而其他所有数据都支持药物的有效性。图3 王亚宁博士展示的阿杜卡玛单抗临床试验数据[11]
曾参与阿尔茨海默病药物开发多年的Klaith告诉知识分子,这个药物能够获得FDA批准,定量药理学在其中的关键作用如今已非常明确:“我印象里,阿杜卡玛单抗可能是第一个把定量药理学内容写入说明书的药物,但是相比统计学,定量药理学距离大家仍然很远。”尽管FDA内部的争议最终以同意批准上市为结局,但目前来看,相比说服FDA的统计部门,临床疗效的拥趸更为广泛,这也促成了目前阿杜卡玛单抗的尴尬现状。来自加州大学洛杉矶分校的 Steven Usdin 认为FDA对替代终点缺乏明确的认识,是导致这一灾难的潜在原因之一。他指出,CMS与FDA的分歧表明在公共讨论还未能就替代终点达成共识 [12]。宾夕法尼亚州费城宾夕法尼亚记忆中心(Penn Memory Center)的联席主任 Jason Karlawish 说:“尽管淀粉样蛋白假说在过去的几十年里占主导地位,但斑块水平降低与认知能力改善之间的联系 ‘充其量只是微不足道的’ ”。英国失智症研究所(UK Dementia Research Institute)所长 Bart De Strooper 说,“大多数淀粉样蛋白试验的问题在于,其没有任何的副作用,当然也没有任何有效作用。”虽然FDA继续为批准进行辩护,但专家们表示,强烈的反弹已经导致该机构越来越不愿意使用加速申请上市途径。目前,美国国会基于阿杜卡玛单抗案例,正在考虑对FDA的加速审批制度进行改革 [13]。
淀粉样斑块病理是阿尔茨海默症的一个定义特征,靶向Aβ蛋白仍然是占主导地位的药物研究范式。回顾一下该领域的主要三期实验,我们发现,以Aβ为靶点的药物对认知终点的改善效果均不理想。自2000年Aβ疫苗AN1792进入临床二期开始,20余年的时间里涌现大量的Aβ靶点药物(图4),包括疫苗,γ-分泌酶/BACE1抑制剂和Aβ抗体,几乎全部以失败告终。图4 进入三期临床的Aβ抗体靶点药物[14]
在抗体靶向的Aβ表位和表位亲和力上,最初针对Aβ单体和寡聚态的抗体对Aβ斑块的消除几乎无效。直至今日,在临床双盲实验中表现出突出消除效率的药物仍屈指可数。除Aducanumab外,Donanemab,Lecanemab由于其独特的Aβ表位(pE3Aβ和E22GAPP),在二期临床实验中斑块消除率表现不俗。Aducanumab更为特殊,除了精心筛选的靶点特异性外,其作为一款全人源抗体,具有高亲和力的天然优势。(图5)
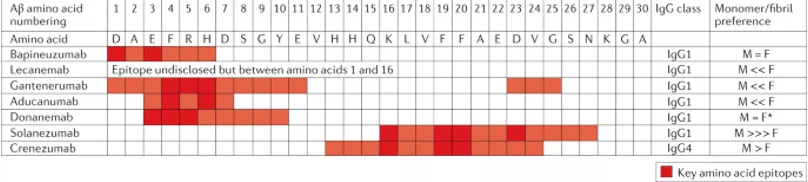
图5 Aβ抗体的靶向表位[14]
回到最初的问题,清除淀粉样蛋白是否可以为治疗阿尔茨海默氏症呢?正如2015年bapineuzumab实验失败时, John C S Breitner(加拿大痴呆症预防研究主席)强调的那样:“科学发现需要可证伪的假设。” [15]今年三月,罗氏与基因泰克宣布开展一项为期四年的试验,他们将测试另一款全人源抗体Aβ斑块抗体gantenerumab,观察其对脑内已有斑块积聚而尚未显示认知症状的患者的长期认知缓解功效。该研究声称可以为上述问题提供一个结论性的答案。众多药企已经付出了巨大的代价,我们期待这次来之不易的尝试可以为我们提供更为明晰的证伪标准。阿尔茨海默症的研究依旧需要社会各界的共同努力,除Aβ外,针对tau蛋白的疫苗AADvac1在去年完成的二期实验中表现积极;干细胞疗法的兴起也获得越来越多的关注。相信只要我们没有停在原地,就是AD患者的福音。